Riesgo de propagación epidémica de COVID-19
en Veracruz, México
Rodrigo Tovar Cabañas
Universidad Autónoma de Tlaxcala, Tlaxcala, México;
correo electrónico: rod_geo77@hotmail.com.
ORCID: http://orcid.org/0000-0003-4873-2502
Felipe Roboam Vázquez Palacios
Centro de Investigaciones y Estudios Superiores en Antropología Social (CIESAS) Unidad Golfo, México
correo electrónico: fevaz19@gmail.com.
ORCID: https://orcid.org/0000-0003-3895-6887
Shany Arely Vázquez Espinosa
Universidad Autónoma de Tlaxcala, Tlaxcala, México;
correo electrónico: shanyvaz@gmail.com.
ORCID: http://orcid.org/0000-0002-6866-0326
José Alfredo Jáuregui Díaz
Universidad Autónoma de Nuevo León, Instituto de Investigaciones Sociales, Nuevo León, México; correo electrónico: alfjadi@yahoo.com.mx.
ORCID: http://orcid.org/0000-0002-2518-8818
Recibido el 22 de junio de 2020; aceptado el 9 de marzo de 2021
Resumen: El riesgo de propagación de infecciones virales es un tema emergente dado los brotes de influenza y SARS-CoV-2 que están impactando particularmente a Brasil y México. El objetivo de esta investigación consistió en elaborar un mapa de riesgo de propagación viral, capaz de tipificar el grado de riesgo de cada uno de los municipios del estado de Veracruz, México. La ruta metodológica consistió en la selección de cuatro parámetros para la confección de patrones de propagación epidemiológica, mismos que se procesaron con técnicas geoestadísticas. Los resultados, destacan que los 20 municipios veracruzanos con mayor nivel de riesgo coinciden con lo acontecido en los primeros 90 días de la epidemia.
Palabras clave: Geografía de riesgos, epidemiología cultural, SARS-CoV-2, Veracruz.
Risk of epidemic propagation of COVID-19 in Veracruz, Mexico
Abstract: The risk of spreading viral infections is an emerging issue given the outbreaks of influenza and SARS-CoV-2 that are specifically impacting Brazil and Mexico. So the objective of this research is to confection a risk map of viral spread capable of typifying the degree of risk of each of the municipalities of Veracruz, Mexico. The methodological route consists of the selection of four parameters for the preparation of epidemiological propagation patterns, which were processed with geostatistical techniques. The results indicate that the 20 municipalities in Veracruz with the highest level of risk coincide with what happened in the first 90 days of the epidemic.
Key words: risk geography, cultural epidemiology, SARS-CoV-2, Veracruz.
Estado del arte de la propagación epidemiológica
Los virus se encuentran en prácticamente todos los ecosistemas de la Tierra, actualmente se han descrito más de 5 000 virus en detalle, aunque se estima que hay millones de tipos distintos, por lo que, desde hace medio siglo, se investigan para ser usados como herramientas nanotecnológicas para la medicina constructiva. El Comité Internacional de Taxonomía de Virus (ICTV, por sus siglas en inglés) reconoce 2 083 especies. La mayoría de ellos miden entre 10 y 300 nanómetros (de 0.01 a 0.3 micras), siendo el Pithovirus sibericum el más grande del mundo, con una longitud de hasta 1.5 micras. La mayoría de los virus se agrupan en cuatro formas estructurales principales: hélice, icosaédrica; foliar y compleja (caso de los bacteriófagos). Ningún virus tiene la capacidad de metabolizar por sí mismo, por lo que depende de un organismo huésped para su replicación, las vías principales de ataque viral son: ingesta respiratoria, ingestión, contacto dérmico y contacto con fluidos corporales. Las principales enfermedades humanas causadas por virus son: varicela, VIH, influenza, marburg (fiebre hemorrágica), ébola, hanta (zoonótica atribuida a roedores), gripe aviar, herpes labial y resfriado común (Hogan, 2010).
La velocidad de propagación de una enfermedad viral (epidemia) se correlaciona con una serie de factores, siendo la densidad de población humana y el saneamiento, dos de los más importantes. Sin embargo, existe evidencia de que muchos virus altamente letales se encuentran en biomas remotos, donde las epidemias a veces se desencadenan cuando los humanos invaden dichos biomas, que pueden haber estado aislados durante largos períodos de tiempo, caso de los paleovirus siberianos. También existen poblaciones regionales con un alto porcentaje de portadores asintomáticos de la enfermedad (zonas endémicas), que al ser contactadas también suelen desencadenar epidemias, caso del chicunguña de Tanzania.
Además, Orubuloye et al. (1993) observaron que las epidemias modernas se transmiten por personas que trabajan a lo largo de las vías de comunicación, en los principales nodos de transporte y en comercios, puesto que la efervescencia de las relaciones sociales generalmente ocurre en grandes conglomerados urbanos. Es decir, la red carretera ha tenido un papel preponderante en la propagación de infecciones, de hecho, los autores señalan que la propagación de enfermedades epidémicas por las vías de comunicación no es nueva, pues nos recuerdan que las antiguas rutas de caravanas de África se caracterizaban también por sus altos niveles de enfermedades venéreas. Bletzer (1998) se suma a dichos señalamientos puesto que considera que los puntos de venta, la recreación (turismo) y el deambular por las calles son los entornos propicios del riesgo epidemiológico.
En efecto, el crecimiento de la aviación a partir de 1970 comenzó a tener el mismo efecto que el resto de las demás vías de comunicación, puesto que el total anual de pasajeros transportados pasó de los 500 millones en 1975 a más de 4 mil millones en 2019, por lo que sólo fue cuestión de tiempo para que surgiera la primera epidemia trasmitida por vía aérea, la cual tuvo lugar en agosto de 1997, cuando un grupo de 87 pasajeros volaron de Sidney, Australia, a la ciudad de Nueva York, para luego abordar un crucero. En seguida, el 10 de septiembre, seis pasajeros de la tercera edad (todos con al menos una condición crónica de salud) contrajeron influenza A(H3N2). Dicho virus fue caracterizado como A/Sydney/5/97(H3N2) y como A/Wuhan/359/95(H3N2). En esa ocasión las medidas de control epidemiológico empleadas durante la emergencia fueron: confinamiento en camarotes; eliminación de reservorios de virus; profilaxis antiviral (con rimantadina durante 10 días) y hospitalización por complicaciones respiratorias (Miller et al., 2000).
Actualmente es posible llegar a cualquier punto del planeta en menos de 36 horas de viaje, que es un tiempo inferior al tiempo de incubación de la mayoría de los virus que pueden afectar a los viajeros. Este hecho permite entrar en contacto con microorganismos, infectarse, ser portador y pasar desapercibido, de allí que a nivel mundial las enfermedades infecciosas continúan siendo una de las principales causas de mortalidad.
Conforme con Roca y Balanzó (2006) La salud pública mundial, es la disciplina médica que ofrece una respuesta a ese marco sanitario globalizado. Aborda: a) medicina tropical; b) enfermedades emergentes; c) consejos sanitarios para viajeros internacionales; d) geografía médica; e) medicina de la inmigración y f) enfermedades importadas. Las enfermedades infecciosas por migración (EIM), según su distribución geográfica mundial, pueden clasificarse en: 1) EIM tropicales: paludismo (que en España acabó con dos mil casos de 1999 a 2002); esquistosomiasis (parasitosis); amebiasis y filariosis, y 2) Enfermedades Cosmopolitas Importadas (ECI): tuberculosis (la cual a nivel mundial produce en promedio dos millones de muertes por año).
Dentro de la Geografía médica, existe la cartografía de riesgos sanitarios, la cual consiste en la elaboración de mapas de propagación de infecciones virales, donde a partir de parámetros como: ubicación espacial, movimiento, registros demográficos, densidad, vectores de ubicación euclidiana, medidas de bioseguridad, detección de casos sospechosos, velocidad de transmisión, vecindad directa de un infectado y tasa de viajeros; se logra tipificar a las distintas áreas geográficas (polígonos urbanos) y establecer las estrategias de intervención para cada una de ellas.
Un hecho importante de esta rama del saber ha sido señalado por Boender et al. (2007), quien documentó que la probabilidad de transmisión depende de la distancia al foco de prevalencia, la cual puede ser calculada, como en el caso de la fiebre aftosa que en 2001, obligó a matar a 6 millones de vacunos en Gran Bretaña, o la gripe aviar H7N7 que, en 2003, mató a 30 millones de aves en los Países Bajos. Sólo se salvaron aquellos sitios alejados a más de 25 km de cualquier foco de prevalencia, dicha investigación enseñó que existen parámetros no considerados en la razón de momios, tal como las aves silvestres, que fungieron como vectores de propagación viral entre puntos cercanos aparentemente inconexos.
En el caso de las infecciones virales en humanos (Steffen, 2010) estimó la tasa de incidencia de influenza estacional entre viajeros internacionales en 1% por mes. Al respecto, dice que, si bien la Organización Mundial de la Salud (OMS), dada la baja tasa señalada, no recomienda explícitamente restringir los viajes nacionales, la historia ha revelado la presencia de otras variedades de virus respiratorios, tal como: rinovirus, coronavirus, influenza y virus parainfluenza, lo que ilustra que muchas diferentes transmisiones virales pueden ocurrir simultáneamente durante una pandemia.
También (Steffen, 2010) advierte que la detección de casos de Síndrome Respiratorio Agudo Severo (SARS) en viajeros enfermos a través de escaneo térmico en las fronteras internacionales prácticamente no suele ser efectivo, puesto que hay miles de pasajeros asintomáticos además de aquellos que suelen usar agentes antipiréticos para pasar el cribado térmico. Por eso el cribado térmico debe realizarse a la salida y a la llegada, además de que como medida profiláctica para obtener visas a eventos masivos (festivales de rock, viajes en cruceros, juegos olímpicos, incluso peregrinaciones, etcétera), debe ser obligatoria la prueba de vacunación contra la pandemia en curso.
De manera complementaria, se pude decir que el modelo sociocognitivo de preparación para desastres de Prati et al. (2011) descubrió que el impacto personal de una pandemia y la gravedad de la misma está relacionado con respuestas afectivas, es decir, en este caso el riesgo percibido está vinculado con factores sociocontextuales, tales como: niveles de preocupación entre las redes familiares personales (vecinos, amigos y parientes) y credibilidad de las campañas mediáticas. Por ejemplo, en retrospectiva, como en Italia las pandemias, desde la de influenza H1N1 de 2009, suelen ser percibidas como de bajo riesgo o poco terribles, actualmente, puede ser que eso haya influido para que la pandemia de COVID-19 se haya extendido por más de 200 mil habitantes. Para evitar este relajamiento social Prati et al. (2011) recomiendan que las campañas mediáticas usen como refuerzo imágenes, metáforas y narrativas de personajes de fábula, pues estos suelen ayudar a recordar las medidas profilácticas, máxime entre poblaciones gerontológicas.
Otros factores de riesgo nada fáciles de modelar al momento que impacta determinada epidemia son: edad, tamaño del hogar, relación con el paciente índice (p. ej., padre, madre, conyugue o hermanos), enfermedades crónicas preexistentes (cardiovasculares, respiratorias, inmunodeficiencia, etcétera). En tanto que durante la emergencia de una epidemia, según Remschmidt et al. (2013), se pueden considerar como factores de riesgo medibles: los cambios de comportamiento durante un período de siete días después del inicio de los síntomas del paciente índice, el tiempo de convivencia en contacto cercano, haber comido junto con el paciente índice, haber dormido en la misma habitación con el paciente índice, exposición a fómites u objetos contaminados, cambios en el comportamiento de higiene y haber adoptado otras medidas para prevenir infecciones, tal como la sana distancia.
Como puede observarse, con dichos parámetros es posible calcular la tasa de ataque epidemiológico secundario, que según Remschmidt et al. (2013), suele ser cercana al 10%. Tales autores también observaron que dicha tasa de ataque epidemiológico secundario aumenta cuando la edad de la población es más joven, donde los hermanos tienen el mayor riesgo de SARS seguido por la madre o el padre del paciente índice. Igualmente señalan que en esta etapa los factores de riesgo conductual no son estadísticamente significativos excepto cuando el tiempo de contacto excede de ocho horas. Por otra parte, es útil señalar que la propaganda emitida por los servicios públicos y el papel de los médicos centinelas puede ayudar a adoptar mejores prácticas de higiene, finalmente señalan que cualquier infección secundaria se adquiere dentro de los hogares. Ahora bien, como el propio Remschmidt et al. (2013) señala, tal enfoque es útil para estimar el riesgo de ataque epidemiológico secundario, más no para pronosticar el riesgo de propagación de la primera oleada de la epidemia.
La contención del primer ataque epidémico depende de la capacidad de todos los países para detectar rápida y oportunamente amenazas a la salud pública in situ. De allí que la OMS utilice y defina el enfoque de comunicación de riesgos como: el intercambio en tiempo real de información, asesoramiento y opiniones entre expertos y personas involucradas para enfrentar una amenaza que signifique peligro para la supervivencia, la salud, el medio ambiente o el bienestar socioeconómico.
En esa línea, hace cinco años, la OMS adoptó un nuevo método de evaluación destinado a valorar la capacidad de cada país para prevenir, detectar y responder rápidamente a las amenazas de la salud pública independientemente de si son de ocurrencia deliberada, accidental o natural (Tabla 1). Los principales elementos de dicha evaluación son:
- • Capacidad durante el evento; este elemento se compone de una serie de indicadores que miden la comunicación temprana y rápida hacia el público en coordinación con sectores de salud pública y animal.
- • Capacidad posterior al evento, con la cual se evalúa el nivel de confianza que el público le tuvo a las instituciones gubernamentales dedicadas al manejo de determinadas pandemias.
- • Entrenamiento en epidemiología, enfocado para que la comunicación de riesgos sea estandarizada e institucionalizada.
Por ejemplo, desde el año 2017, China viene practicando simulacros de brotes hipotéticos epidémicos (Frost et al., 2019). Otras simulaciones de propagación de virus se han realizado en Estados Unidos: en 2001 y 2005 se escenificó la vulnerabilidad de ese país. Ante un brote de viruela modificada, en la Conferencia Internacional de Comunidades Seguras de 2008, se exhibieron otras dos modelaciones de pandemias mundiales.
Tabla 1
Principales incidentes virales, 1928-2018
Año |
Incidente |
1928 |
Experimentación con tifus, muermo y melioidosis en Solovetsky |
1958 |
Bombardeo con aedes aegypti sobre el estado de Florida |
1971 |
Accidente de viruela sobre el mar de Aral |
1977 |
Robert Gallo inició el cultivo de células T y los virus que las afectan |
1978 |
Accidente con viruela Birmingham, Reino Unido |
1981 |
Aparición epidémica del VIH |
1981 |
Brote de dengue en Cuba (300 mil infectados) |
1989 |
Estados Unidos envió muestras a Irak de virus del Nilo Occidental |
1990 |
Armas biológicas: ántrax, ébola, marburg, fiebre Q, y viruela |
1992 |
Biopreparat desarrolló armas biológicas: influenza |
1993 |
Aparición de virus quimera: ébolapox |
1999 |
Muestras de virus fueron robados de laboratorios occidentales |
2002 |
La OMS aprueba la conservación temporal del virus de la viruela |
2012 |
La biología sintética da inicio a la era de los virus quimera |
2014 |
Accidente con viruela en Maryland, Estados Unidos |
2015 |
La OMS reconoce la factibilidad para fabricar viruela sintética |
2018 |
La OMS prohíbe fabricar más del 20% del genoma de viruela |
Fuente: elaboración personal con base en trabajo hemerográfico.
Otros elementos indispensables para prevenir, detectar y responder rápidamente a las amenazas de la salud pública son: el Entrenamiento Regional y Rural para la Comunicación de Riesgos y Emergencias (talleres de trabajo); los Observadores Extranjeros, al respecto, es necesario estar abierto a la crítica extranjera para evaluar la eficacia de los planes de comunicación de riesgo e identificar las trabas que hacen que dichos planes no funcionen, como ocurre cuando los líderes no articulan ni practican los principios de comunicación de riesgos; también es vital construir la Voz Oficial para Emergencias de Salud Pública y fomentar el hábito de chats web sobre temas vinculados a las enfermedades epidémicas, tales como: casos de rabia, de hepatitis, así como los relacionados con la conmemoración del día mundial de la tuberculosis, importancia de la vacuna contra la gripe estacional, qué es el ébola de África Occidental, etcétera; la Construcción de Comunicadores, por ejemplo, en 2017, China había graduado a 288 epidemiólogos (Frost et al., 2019); así como la Capacitación de Comunicadores como parte de una fuerza mediática y de respuesta para la efectiva capacidad de comunicación de riesgos; finalmente no hay que olvidar los Manuales de Manejo de Riesgos y Emergencias de Salud Pública, dentro de los cuales los mapas de riesgo de propagación epidémica son de importancia medular.
Las epidemias en México
En el territorio mexicano, de los siglos XVI al XVIII, ocurrieron cientos de epidemias, decenas de sindemias y varias pandemias, las cuales impactaron a cientos de poblados. Por la extensión territorial de la infección y la cantidad de decesos, durante el siglo XVI ocurrieron cuatro grandes pandemias, concernientes a los periodos de: 1519-1522 (viruela o matlazahuatl); 1530-1532 (sarampión o acazahuatl); 1544-1546 (salmonela o cocoliztli) y 1575-1577 (viruela y salmonela), en orden de prelación los estados más afectados fueron Tlaxcala, Puebla, Estado de México, Ciudad de México y Chiapas (Tabla 2).
Durante el siglo XVII se dieron cuatro pandemias, correspondientes a los periodos de: 1634-1636 (salmonela o cocoliztli); 1647-1649 (viruela o matlazahuatl); 1658-1660 (salmonela y viruela), y 1692-1694 (paludismo, sarampión y viruela), en ese siglo, en orden de prelación los estados más afectados fueron: Tlaxcala, Puebla, Ciudad de México, Yucatán y Chiapas; en el siglo XVIII ocurrieron cuatro pandemias, concernientes a los periodos de: 1735-1736 (hepatitis y viruela); 1761-1763 (viruela); 1779-1786 (viruela, escarlatina e influenza) y 1796-1798 (viruela), los estados más afectados fueron: Puebla, Ciudad de México, Estado de México, Oaxaca y Michoacán (Tabla 2).
Tabla 2
Principales epidemias en el territorio mexicano, 1519-1798
Periodo |
Epidemia |
Periodo |
Epidemia |
1519-1522 |
viruela o matlazahuatl |
1658-1660 |
salmonela y viruela |
1530-1532 |
sarampión o acazahuatl |
1692-1694 |
paludismo, sarampión y viruela |
1544-1546 |
salmonela o cocoliztli |
1735-1736 |
hepatitis y viruela |
1575-1577 |
viruela y salmonela |
1761-1763 |
viruela |
1634-1636 |
salmonela o cocoliztli |
1779-1786 |
viruela, escarlatina e influenza |
1647-1649 |
viruela o matlazahuatl |
1796-1798 |
viruela |
Fuente: elaboración propia con base en García et al., 2003.
Según el Centro Nacional en Prevención de Desastres (CENAPRED, 2018), durante el siglo XIX ocurrieron tres epidemias de considerable gravedad: la epidemia de tifo ocurrida en Cuautitlán, Estado de México en 1813, el cólera que en 1833 mató a más de 300 mil personas por todo el territorio nacional, y la fiebre amarilla ocurrida en Mazatlán, Sinaloa en 1883. Según Molina et al. (2013), durante dicho siglo, también se dieron las epidemias de: sarampión ocurrida en Actopan, Hidalgo en 1825; el cólera en Tlaxcala en 1855; la tuberculosis de Puebla en 1891 y el tifo de la ciudad de México de 1892.
En tanto que, durante la primera mitad del siglo XX acontecieron cinco epidemias: la epidemia de tuberculosis ocurrida en Veracruz 1901 (Canada, 1901), la epidemia de tifo ocurrida en todo México entre los años de 1915 y 1918 (Burns et al., 2014; Alexander, 2020), la epidemia de influenza o gripe española de 1918-1919 (Cano, 2013), el cólera ocurrido en Yucatán en 1924 (Quezada, 2012) y la epidemia de tuberculosis que se anidó de 1931 a 1939 en la ciudad de México (Agostoni, 2017, 2019). Los brotes de tuberculosis han continuado a lo largo del siglo XX, en 1968 apareció un brote epidémico en la frontera México-Estados Unidos (Neves, 1968), el cual se extendió a todo México entre los años de 1980 y 1981 (Verduzco, 1980; Báez et al., 2003), su última aparición en ese siglo fue en Veracruz, principalmente en Orizaba entre 1993 y 1995 (Bustamante et al., 1996; Sifuentes, 2006).
Además, en la segunda mitad del siglo XX tuvieron lugar siete epidemias más: en 1972 se dieron brotes aislados de salmonela y tifoidea por todo el territorio nacional (Luna et al., 1972; Baine et al., 1977), en 1976 aun existían casos de poliomielitis en Tabasco (Zárate et al., 1976) y Sinaloa (González et al., 1976), en ese mismo año, más el de 1977, surgió un brote de influenza en la ciudad de México (Pizarro et al., 1977; Aguirre y González, 1992), los primeros casos de la pandemia mundial de VIH aparecieron en México entre 1981 (Magis y Loo 1996) y 1985 (Góngora et al., 2005).
En 1984, Yucatán experimentó una fuerte epidemia de dengue (Loroño et al., 1993), en tanto que de 1986 a 1990 se extendió por todo el territorio nacional una epidemia de hepatitis (Velázquez et al., 1990; Perdigón y Fernández, 2009), finalmente la última epidemia, de ese siglo XX, que afecto a todo el centro de México, fue la de cólera de 1991 (Lizárraga y Quilici, 2009).
Ahora bien, de la última década del siglo pasado, al final de la primera década del siglo XXI, en función de la cantidad del número de casos, podemos considerar a las infecciones respiratorias agudas (IRAs), incluida la influenza, así como a la neumonía, el paludismo, la tuberculosis y la tosferina, como las cinco principales epidemias de origen biológico/ambiental de los últimos 30 años. De modo tal que podemos graficar su comportamiento en cada uno de los estados de la República Mexicana. La Tabla 3, relativa a la tendencia que han tenido las epidemias de IRAs durante los últimos 30 años, revela que los estados de México, Tlaxcala, Guanajuato y Jalisco, han reducido poco ese flagelo. Por el contrario, los estados de Colima, Baja California Sur, Nayarit y Chihuahua presentan el saldo más favorable en cuanto a reducción de la tasa de IRAs se refiera. Lo que significa que Tlaxcala, Estado de México, Guanajuato o Jalisco son entidades muy vulnerables a epidemias de este tipo.
En términos estadísticos la Tabla 4 resume la tendencia que han tenido las epidemias de neumonía durante los últimos 30 años. Los estados Colima, Sonora, Jalisco, Durango y Coahuila, presentan las tasas epidemiológicas más graves de neumonía. Dado este resultado, al parecer el micro hongo Pneumocystis jirovecii parasito del árbol respiratorio del ser humano, vector fitógeno de la neumonía ocupa o se reproduce bien en tales entidades federativas, por lo que la neumonía en dichas circunstancias puede considerarse como una endemia. No obstante Colima, Sonora y Jalisco son particularmente vulnerables a endemias o epidemias de este tipo.
Tabla 3
Tasa decadal de epidemias por infecciones respiratorias agudas en México
Estado |
Tasa por cada 10 mil habitantes |
|||
|
1990 |
2000 |
2010 |
Saldo |
Tlaxcala |
0.6 |
1.09 |
0.23 |
-0.38 |
México |
0.42 |
0.26 |
0.02 |
-0.4 |
Guanajuato |
0.72 |
0.5 |
0.04 |
-0.68 |
Jalisco |
0.93 |
0.45 |
0.16 |
-0.77 |
Hidalgo |
0.89 |
0.52 |
0.11 |
-0.78 |
Chihuahua |
0.27 |
0.91 |
0.14 |
-3.13 |
Campeche |
0.52 |
1.76 |
0.26 |
-3.26 |
Nayarit |
0.7 |
0.56 |
0.45 |
-4.25 |
Colima |
0.4 |
1.01 |
0.25 |
-5.15 |
Baja California Sur |
6.19 |
1.62 |
0.52 |
-5.67 |
Fuente: elaboración propia con base en INEGI, 1990; 2000; 2010; Secretaría de Salud, 2017.
Tabla 4
Tasa decadal de epidemias por neumonía en México
Estado |
Tasa por cada 10 mil habitantes |
|||
|
1990 |
2000 |
2010 |
Saldo |
Colima |
134.6 |
135.3 |
172.6 |
38.0 |
Sonora |
13.7 |
30.0 |
31.9 |
18.2 |
Jalisco |
6.6 |
15.5 |
22.7 |
16.0 |
Durango |
9.9 |
26.4 |
25.7 |
15.9 |
Coahuila de Zaragoza |
12.8 |
20.3 |
28.4 |
15.6 |
México |
2.7 |
5.3 |
4.6 |
1.9 |
Chihuahua |
1.9 |
3.2 |
2.3 |
0.4 |
Morelos |
14.5 |
14.0 |
13.9 |
-0.6 |
Tlaxcala |
11.7 |
17.8 |
11.0 |
-0.7 |
Querétaro de Arteaga |
15.5 |
16.6 |
11.5 |
-4.1 |
Fuente: elaboración propia con base en INEGI, 1990; 2000; 2010; Secretaría de Salud, 2017.
El caso del paludismo, dadas las bajas tasas epidémicas, menores a una persona por cada 100 mil habitantes dentro de los casos estatales más agudos, puede considerarse como una epidemia con portadores más o menos asintomáticos, es decir, los genotipos mexico-orignarios han desarrollado en buena medida inmunidad a dicha enfermedad. Incluso, en algunos estados, como el caso de Oaxaca, Campeche podría declararse como erradicada para la población local.
Por otra parte, la Tabla 5 estadísticamente sintetiza la tendencia que han tenido las epidemias de tuberculosis durante los últimos 30 años. Los estados Baja California Norte, Guerrero, Sonora, Sinaloa y Tamaulipas, presentan las tasas epidemiológicas más altas de tuberculosis. Por el contrario, los estados de Colima, Querétaro, Hidalgo, Nayarit y Puebla presentan el saldo más favorable en cuanto a reducción de la tasa de tuberculosis se refiera. Por tanto, es útil saber que Baja California Norte, Guerrero, Sonora, Sinaloa y Tamaulipas son característicamente más vulnerables a epidemias de tuberculosis.
Tabla 5
Tasa decadal de epidemias por tuberculosis en México
Estado |
Tasa por cada 10 mil habitantes |
|||
|
1990 |
2000 |
2010 |
Saldo |
Baja California Norte |
1.9 |
2.74 |
4.1 |
2.2 |
Guerrero |
1.46 |
3.11 |
3.07 |
1.6 |
Sonora |
1.13 |
1.82 |
2.19 |
1.06 |
Sinaloa |
1.31 |
1.86 |
2.36 |
1.05 |
Tamaulipas |
1.98 |
2.94 |
3.02 |
1.04 |
Puebla |
0.84 |
0.7 |
0.67 |
-0.17 |
Nayarit |
2.62 |
2.32 |
2.36 |
-0.26 |
Hidalgo |
1.17 |
1.03 |
0.89 |
-0.27 |
Querétaro de Arteaga |
1.13 |
0.63 |
0.73 |
-0.39 |
Colima |
8.91 |
7.17 |
7.76 |
-1.16 |
Fuente: elaboración propia con base en INEGI, 1990; 2000; 2010; Secretaría de Salud, 2017.
En cuanto a la tendencia de epidemias derivadas por tosferina, a lo largo de los últimos 30 años, existe un saldo con números negativos en 31 entidades, con excepción del estado de Nuevo León en donde la tendencia se mantiene estacionaria o ligeramente hacia el incremento. Este hallazgo, en términos sociales puede señalar la presencia de tosferina en el estado de Nuevo León, así como en el de Chihuahua y Jalisco, como una evidencia de vulnerabilidad hacia dicha enfermedad (Tabla 6).
Tabla 6
Tasa decadal de epidemias por tosferina en México
Estado |
Tasa por cada 10 mil habitantes |
|||
|
1990 |
2000 |
2010 |
Saldo |
Nuevo León |
0.04 |
0 |
0.07 |
0.03 |
México |
0.03 |
0.01 |
0.02 |
-0.01 |
Tlaxcala |
0.04 |
0.01 |
0.01 |
-0.03 |
Chihuahua |
0.03 |
0 |
0 |
-0.03 |
Jalisco |
0.06 |
0 |
0.02 |
-0.04 |
Querétaro de Arteaga |
0.25 |
0.01 |
0.01 |
-0.24 |
Nayarit |
0.29 |
0.01 |
0 |
-0.28 |
Hidalgo |
0.34 |
0.02 |
0.01 |
-0.33 |
Oaxaca |
0.43 |
0.01 |
0.01 |
-0.42 |
Colima |
2.11 |
0.29 |
0.1 |
-2.01 |
Fuente: elaboración propia con base en INEGI, 1990; 2000; 2010; Secretaría de Salud, 2017.
Conforme al panorama expuesto, se puede argumentar que la prevención y control epidemiológico, de no planificarse, es difícil de manejar, debido a varios factores, tales como: tamaño microscópico y durabilidad ex vivo de los distintos agentes virales, vulnerabilidad de las poblaciones humanas, incremento exponencial tanto de accidentes virales como de contacto con nuevos biomas virogénicos, multiplicación de viajes continentales como de densidad de población humana. Al respecto, se insiste en que la geografía médica, a través de la cartografía de riesgos sanitarios, en particular, mediante el mapeo de propagación de riesgos virales es una herramienta vital para planificar, controlar, manejar y comunicar de manera oportuna una pandemia, como la derivada del COVID-19, de allí la importancia de tener mapas de riesgo de propagación actualizados, como el que se va a exponer para el caso del estado de Veracruz.
Área de estudio
El estado de Veracruz, es una de las 32 entidades federativas de la República Mexicana, sus coordenadas extremas son: norte 22° 28’ y sur 17° 09’ de latitud norte y; este 93° 36’ y oeste 98° 39’ de longitud oeste. Cuenta con una superficie cercana a los 72 mil km2 (INEGI, 2016). Ubicado en la porción oriental del país, cuenta con 212 municipios, varios de ellos son puertos marítimos y aéreos. Pese a que su distribución territorial tiene una dirección preferencial norte-sur, dada su baja altitud la mayoría de sus municipios cuentan con un clima cálido o semicálido tropical (Figura 1).

Figura 1. Localización del Estado de Veracruz, México.
Fuente: elaboración personal
Demográficamente es la tercera entidad federativa más poblada de México con un total de 7,643,194 habitantes al censo de 2010, sus cinco ciudades más grandes son: el puerto de Veracruz, Xalapa, Coatzacoalcos, Poza Rica y Minatitlán, además de contar con más de 15 zonas metropolitanas con población entre 10 y 30 mil habitantes, ocho más con población entre 30 y 50 mil habitantes y 9 con población entre 50 y 100 mil habitantes.
Estas cuatro decenas de centros urbanos, concentrados en 112 municipios merecen un análisis cartográfico de riesgo de propagación epidemiológico, máxime si se recuerda que en 2009 en el municipio de Perote surgió el brote de la epidemia de influenza H1N1, todo ello con la intención de abonar al manejo de epidemias como la que actualmente vive dicha entidad federativa.
Metodología
Para la confección del mapa de riesgo de propagación epidemiológico por agentes virales trasmisibles por fómites, superficies contaminadas y de persona a persona se emplearon cuatro principales tensores o parámetros fundamentales: densidad vial (expresada en kilómetros lineales por hectárea urbana), densidad vehicular (referida a cantidad de automóviles por kilómetro lineal), automóviles por habitante urbano y densidad de locales comerciales (unidades por hectárea urbana). La densidad de población, el hacinamiento y otras cuantas variables fueron descartadas debido a que su empleo es más propio de escalas más pequeñas, como para estimar el comportamiento del riesgo al interior de los núcleos urbanos, no para estimar el riesgo a nivel estatal.
Por lo tanto, aquí se ha asumido que la densidad vial es una medida del espacio comunicacional, de la interacción social, en donde a mayor densidad vial mayor espacio para interactuar, ergo, mayor riesgo de propagación viral. Este parámetro, en países como México, que cuentan con cartografía vectorial a escala urbana, es relativamente fácil de calcular su razón, el único inconveniente estriba en que se requiere de un procesador con memoria RAM igual o superior a los 32 gigabytes para poder medir la longitud de alrededor de 250 mil polilíneas, que en este caso computan la red vial de calles del estado de Veracruz.
La densidad vehicular es un parámetro que contribuye a calibrar la densidad vial, puesto que suelen existir casos con idéntica densidad vial, pero con diferente parque vehicular. En estos casos, una mayor densidad vehicular significa que existe relativamente mayor proximidad entre dos objetos, por lo que sus posibilidades de interactuar son mayores, es decir, en altas densidades vehiculares existe mayor riesgo de propagación viral. Este parámetro es producto de la razón de dividir la cantidad de autos que reporta el censo de INEGI (2010), para una localidad urbana, entre la suma total de su red vial del propio INEGI (2016).
La cantidad de automóviles por habitante urbano es un parámetro de utilidad para estimar de forma complementaria el espacio comunicacional, en donde la mayor cantidad de personas que relativamente tendrían que compartir un automóvil, refleja indirectamente que los fómites para interactuar (andenes, paradas de autobús, autobuses, pasillos urbanos, etcétera) están más congestionados, ergo, mayor riesgo de propagación viral. Las variables de este parámetro, se obtienen del censo de INEGI (2010).
La densidad de locales comerciales, al igual que la densidad de población es un parámetro que calcula cantidad de elementos por unidad de superficie, en este caso se ha asumido que la mayor concentración de locales comerciales contribuye potencialmente a una mayor interacción entre los vectores de transmisión de la infección viral, por tanto, a mayor densidad de locales comerciales mayor riesgo de propagación viral. Las variables de este parámetro, se obtienen del Directorio Estadístico Nacional de Unidades Económicas, DENUE, de INEGI (2019) y la cartografía vectorial urbana del propio INEGI (2016). Es necesario contar con un procesador RAM superior a 32 gigabytes para poder filtrar los dos millones de celdas que contiene aproximadamente el DENUE destinado al estado de Veracruz.
Estos parámetros fueron procesados geoestadísticamente mediante una matriz de cociente de localización, la cual es una medida de la proporción que una variable determinada representa en una superficie urbana comparada con la proporción de la misma variable a nivel estatal, los resultados indican el grado de concentración que tiene una demarcación urbana en algún parámetro considerado (Vázquez et al., 2013), por ejemplo, en este caso: densidad vehicular, densidad vial, densidad de locales comerciales, etcétera. Su expresión matemática conforme a (Vázquez, 2013) es:
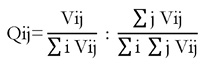
Dónde:
Vij= Se refiere al valor V correspondiente al indicador i de la región de análisis j
∑i Vij= se refiere al valor de V correspondiente al total local
∑j Vij= se refiere al valor de V correspondiente al total de los indicadores
∑i, ∑j Vij= total de la región de análisis
Su ordenamiento en una matriz se ejemplifica a partir de un cuadro de contraste entre sectores contra regiones, en este caso, los sectores (S) se refieren a los parámetros de propagación viral, y las regiones (R) se refieren a las unidades geográficas de estudio (manchas urbanas de los municipios de Veracruz), en este caso, tales unidades se corresponden con las Áreas Geoestadísticas Básicas (AGEBs) de los municipios bajo estudio, su representación visual puede apreciarse en la tabla 7. En ese caso pedagógico, los sectores de mayor significación para la muestra total territorial serían: en primer lugar, S1 para la región 2 (R2), seguido de S3 para R1, y S4/R3, y así sucesivamente. La representación cartográfica de los resultados se realizó en GvSIG 2.4.
Tabla 7
Ejemplo de una matriz para calcular el cociente de localización
Datos de entrada |
||||
S/R |
R1 |
R2 |
R3 |
∑j |
S1 |
20 |
100 |
80 |
200 |
S2 |
25 |
75 |
150 |
250 |
S3 |
10 |
20 |
50 |
80 |
S4 |
45 |
95 |
330 |
470 |
∑i |
100 |
290 |
610 |
1000 |
Valores relativos |
||||
SEC/REC |
R1 |
R2 |
R3 |
∑j |
S1 |
0.2 |
0.34 |
0.13 |
0.2 |
S2 |
0.25 |
0.26 |
0.25 |
0.25 |
S3 |
0.1 |
0.07 |
0.08 |
0.08 |
S4 |
0.45 |
0.33 |
0.54 |
0.47 |
∑i |
1 |
1 |
1 |
1 |
Cálculo de valores Qij |
||||
SEC/REC |
R1 |
R2 |
R3 |
|
S1 |
1 |
1.7 |
0.65 |
|
S2 |
1 |
1.04 |
1 |
|
Cálculo de valores Qij |
||||
SEC/REC |
R1 |
R2 |
R3 |
|
S3 |
1.25 |
0.88 |
1 |
|
S4 |
0.96 |
0.7 |
1.15 |
|
Fuente: elaboración propia con base en Vázquez, 2013.
La representación espacial de los resultados estadísticos se exhibe mediante mapas de coropletas del riesgo de propagación de alguna epidemia de corte viral (Figura 2), en casos específicos es necesario aplicar alguna correlación geográfica para ponderar los resultados y obtener las zonas prioritarias, es decir, zonas que tanto estadística como geográficamente se encuentran en la antesala de algún desastre detonado por algún fenómeno antropogénico adicional, como por ejemplo, el papel de un monopolio de transporte público, la existencia de
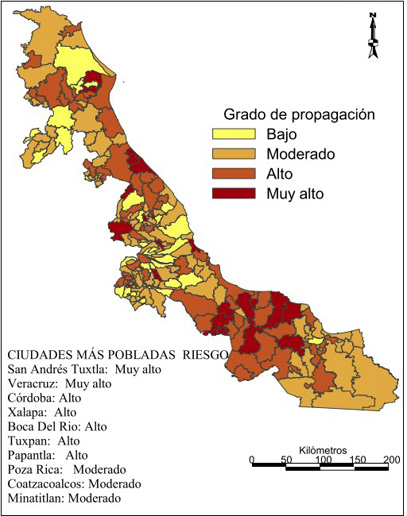
Figura 2. Mapa de riesgo de propagación epidemiológica por municipios, Veracruz 2020.
Fuente: elaboración propia con base en INEGI, 2010, 2016, 2019
un zoológico clandestino. En dicho mapa se empleó la cromática Color Brewer 2.0 sugerida por Dodge et al. (2011) para la mejor visualización y representación cartográfica de fenómenos socio territoriales. Los tonos amarillo claro, denotan bajos niveles, en tanto que los tonos marrones oscuros denotan altos niveles de riesgo de propagación epidemiológica por agentes virales, fómites y por interacción persona a persona.
Resultados y discusión
Con la técnica de análisis espacial con información limitada, expuesta, se pudieron obtener dos patrones de riesgo de propagación de infecciones virales: el primero está referido a los municipios de Veracruz con mayor riesgo de propagación y el segundo describe a los municipios con el menor riesgo de propagación. Dado que el modelo se construyó en el mes de marzo de 2020, antes de que comenzara la estadística en torno a la epidemia en Veracruz, en junio se contaba con un medio de contraste entre el modelo y la tendencia que ha seguido la epidemia luego de 90 días, lo cual ayuda a conocer las concordancias y las limitaciones de la técnica expuesta.
Por ejemplo, considerando las localidades urbanas mayores a 100 mil habitantes, el análisis de riesgo de propagación arrojó a los municipios de: San Andrés Tuxtla (con clave municipal: 141) y Veracruz (193) con la clasificación de riesgo muy alto; Córdoba (44), Xalapa (87), Boca del Río (28), Tuxpan (189) y Papantla (124) con clasificación alta y Poza Rica (131), Coatzacoalcos (39) y Minatitlán (108) quedaron ubicados como municipios con moderado riesgo de propagación de la epidemia de COVID-19 (Figura 2).
Al respecto, luego de tres meses de haberse esparcido dicha epidemia en el estado de Veracruz, conforme a las estadísticas oficiales se observó que el municipio de Veracruz tenía mil 306 casos acumulados, le seguía el municipio de Coatzacoalcos con 412; casos acumulados. Luego, se ubicaban Poza Rica con 300, Boca del Río con 164 y Minatitlán con 146. Si se consideran intervalos de 400 casos y se asumen 4 niveles, se puede notar que efectivamente, Veracruz se mantuvo en la categoría de muy alto o mayor a 1200 casos; en tanto que el intervalo de 800 a 1199 (alto) en ese momento no tenía aun municipios; mientras que el rango 400 a 799 o moderado albergaba a Coatzacoalcos, mientras que el rango de menor a 400 casos o bajo albergó a Poza Rica, Boca del Río y Minatitlán.
Al respecto, se puede argumentar que las ligeras discrepancias entre lo modelado y los hechos estriba en las medidas de contención epidemiológica asumidas por la entidad federativa, sobre todo cabría destacar el caso de Boca del Río, quien se mantuvo entre los municipios con baja cantidad de contagios pese a ser la conurbación más dinámica al puerto de Veracruz.
Ahora bien, conforme a las estadísticas oficiales se constató que los municipios con bajos índices de contagio (municipios de la esperanza) fueron: Los Reyes (con clave municipal: 137), Astacinga (19), Las Minas (107), Alpatláhuac (8), Tlaquilpa (184), Tezonapa (173), Citlaltépetl (35), Mixtla de Altamirano (110), Chontla (63), Tatatila (156), Texhuacán (171) e Ixcatepec (78). De los cuales 9 de ellos, en el modelo, quedaron por debajo del promedio del análisis de riesgo de propagación expuesto (Tabla 8). Lo cual ayuda a valorar este tipo de ejercicios, puesto que se pudo pronosticar, con al menos una semana de anticipación, los lugares relativamente menos riesgosos en medio de una pandemia altamente contagiosa.
Tabla 8
Riesgo de propagación epidemiológica por claves municipales, Veracruz

El color verde indica los niveles más bajos de riesgo de propagación, el nivel rojo señala los niveles más altos, el centro del recuadro marca en amarillo el promedio. Los números corresponden a la clave de los municipios asignada por INEGI. Fuente: Elaboración propia con base en INEGI, 2010; INEGI, 2016; INEGI, 2019.
Otros municipios que se encuentran en alto riesgo de propagación viral, y que no son visibilizados pero que sus localidades cuentan con una población que oscila entre 100 mil y 50 mil habitantes son: Orizaba (118), Tantoyuca (155) y Acayucan (3); y con población mayor a 25 mil, pero menor a 50 mil habitantes, que también están dentro de la categoría de alto riesgo son: Perote (128), Cosamaloapan (045), Tlapacoyan (183), Catemaco (032), Isla (077) y Camerino Z. Mendoza (030).
Al respecto, es útil señalar que el enriquecimiento de los modelos de riesgo de propagación epidemiológica, tanto los generados por razón de momios, como los derivados de técnicas de análisis espacial con información limitada, como el presente, sólo se logrará con la sinergia estadística intersecretarial, mientras tanto, el trabajo expuesto, es el único que se ha realizado, puesto que ni la Secretaria de Salud, ni el Centro Nacional de Prevención de Desastres, considerando la pandemia de influenza del año 2009, tomaron la precaución de coordinar los bancos de datos de los distintos órganos nacionales como para producir una herramienta capaz de mostrar escenarios de riesgos de propagación para la primera oleada de la epidemia viral.
Por ejemplo, un empadronamiento vehicular preciso y georreferenciado ayudaría a refinar el análisis de riesgo de propagación del COVID-19 u otras epidemias virales, de igual modo un censo de mascotas a nivel de AGEBs, que hubiera elaborado la Secretaría de Medio Ambiente y Recursos Naturales, también contribuiría a pulir la precisión de los análisis de riesgo de propagación. Lo mismo puede decirse de la Secretaria de Economía y la necesidad de un censo de comercio ambulante georreferenciado a escala de AGEBs y de la Secretaria de Trabajo y un censo de residencia y lugar de trabajo.
En la praxis, urge que la vigilancia epidemiológica en Veracruz, y en México, adquiera una dimensión del holding intersecretarial, interempresarial e interestatal, además de que su visión tecno-farmacológica transite hacia los paradigmas multidisciplinarios, sobre todo hacia las disciplinas volcadas a los estudios socio-territoriales con la intención de lograr una eficiente comunicación de riesgos. La pandemia de COVID-19 ha revelado que la visión tecnológica dominante que tienen las instancias de gobierno, por una parte, genera una dependencia tecnológica, de allí que países como México estén al amparo de que otras naciones inventen una vacuna para este coronavirus de 2019, y, por otra parte, paraliza el margen de atención de la emergencia, pues esta se limita a las campañas de confinamiento y a algunas vagas medidas profilácticas.
En efecto, la poca inversión en materia de cultura cívica, sobre todo en estrategias de certificación, capacitación y actualización de oficios y gremios con alta interacción social, tales como: taxistas, cocineros, meseros, vendedores ambulantes, cajeros, entre otros, actualmente está cobrando un elevado costo de vidas. Por ejemplo, de nada sirve que desde hace una década circulen, parcialmente, billetes de polímero, sí el Banco de México ni la Secretaría de Salud, ni ninguna otra instancia de gobierno, nunca han recomendado lavar dichos billetes de polímero ni las monedas, sin embargo, esa práctica profiláctica se torna muy eficaz para reducir esos fómites móviles o vectores de transmisión viral.
Otro ejemplo de corte multidisciplinario, el sur de Veracruz, frontera con el estado de Oaxaca se considera una bomba de tiempo epidemiológica para un brote de encefalitis equina venezolana, debido a que desde 1970 se ha confirmado la presencia del alfavirus en las inmediaciones de San Francisco Ixhuatán, oriente de Oaxaca (Correa et al., 1972). De modo que las gripes anómalas del sur de Veracruz deben de tener una mayor observación, sobre todo aquellas que se gestan en las inmediaciones de los nuevos desarrollos urbanos próximos a tales biomas. Al respecto, existen otros focos de riesgo epidemiólogo no atendidos por la visión dominante de la epidemiología, tal como la ingesta de aves silvestres, venados, conejos, iguanas, serpientes, armadillos, tlacuaches, perros y pejelagartos que culturalmente ocurre en los estados de Guerrero, Chiapas, Oaxaca, sur de Veracruz y Tabasco, o bien, en mercados faltos de higiene, tal como el mercado de carnes de Altotonga, Veracruz, este último ubicado a 50 km de la capital del estado.
Conclusiones
La gran cantidad de interacción, turismo, migración y movilidad social sustentada por los sistemas de transporte aéreo, terrestre y marítimo ha acelerado el ritmo de aparición, propagación y distribución de epidemias. Al grado tal que, si la vigilancia epidemiología de un país es burlada por algún virus, en menos de un mes prácticamente todos los países del planeta se enfrentan a sendas epidemias, cómo la de COVID-19 que afecta actualmente a todo el mundo en este 2020.
Ante la imposibilidad y la falta de coordinación mundial para vigilar y contener todos los brotes virales es urgente elaborar y actualizar varios mapas de riesgo de propagación de infecciones virales, donde a partir de parámetros como: ubicación espacial, movimiento, registros demográficos, densidad, vectores de ubicación euclidiana, medidas de bioseguridad, detección de casos sospechosos; velocidad de transmisión, vecindad directa de un infectado y tasa de viajeros, se lograría identificar los sitios estratégicos para contener los brotes epidémicos además de coordinar mejor las estrategias de intervención para cada una de ellas. Es decir, con estadísticas más robustas a escala de AGEBs el país no necesariamente se tendría que esperar a tener datos computados sobre casos acumulados, ni a modelados con razón de momios para establecer mapas de riesgos de propagación viral y acciones inmediatas.
También será útil implementar dentro de los programas escolares la microbiología, y dentro de la educación cívica será crucial explicar cómo se propagan los virus respiratorios, tal como: rinovirus, coronavirus, influenza, parainfluenza o dengue, para que de ese modo la población esté más informada y actúe acorde en tiempos de crisis sanitaria.
En tanto, la vigilancia epidemiológica debe admitir que las campañas mediáticas usen como refuerzo metáforas y narrativas de personajes de fábula, pues estos suelen ayudar a recordar las medidas profilácticas. De igual calidad de importancia para la seguridad nacional es tener capacidad de autocrítica para poder identificar las trabas que hacen que la vigilancia epidemiológica no funcione, como ocurre cuando los líderes, ya sea por estar escasos en la materia o por vivir protagonismos, no articulan ni practican los principios de comunicación de riesgos.
El caso mexicano, estadísticamente, durante los últimos dos siglos ha experimentado diez epidemias por siglo, por lo que este siglo XXI, dado su gran volumen de población, es probable que padezca por lo menos otras cinco grandes pandemias adicionales a la de influenza H1N1 de 2009 y a la de SARS COVID-19. Al respecto es bueno recordar que el estado de Puebla y el de Yucatán históricamente han sido de los más afectados por dichas crisis epidémicas. Ahora bien, conforme a la Dirección General de Epidemiología, las IRAs, la neumonía, el paludismo, la tuberculosis y la tosferina, son las cinco principales epidemias de los últimos 30 años. Cómo puede advertirse, cuatro de estas afectan directamente al sistema respiratorio, en tanto que el paludismo, lo afecta de manera indirecta o secundaria.
Este hecho es importante para exigir mayores controles fitosanitarios a la rama industrial pero también al sector social y gubernamental, es decir, urge reducir las probabilidades de accidentes virales, sobre todo aquellos relacionados con el contacto con nuevos biomas virogénicos o con la aceleración exponencial de los viajes continentales. Un método de bajo costo, pero eficaz es la cartografía de riesgo de propagación, la cual puede contribuir a contener o frenar de manera oportuna un brote durante las primeras semanas a alguna epidemia de corte viral.
Por ejemplo, los patrones de riesgo de propagación de infecciones virales calculados para todos los municipios del estado de Veracruz, ciertamente coinciden de forma bastante aproximada con los hechos ocurridos a 90 días de la llegada de la pandemia de coronavirus a México. De modo que, desde febrero, o antes, técnicamente se hubiese programado la estrategia para contener la emergencia epidemiológica en los municipios que están presentando elevados números de población contagiada, tal como: Veracruz, Orizaba, San Andrés Tuxtla, Tantoyuca, Acayucan, Perote, Cosamaloapan, Tlapacoyan, Catemaco, Isla y Camerino Z. Mendoza.
Como se puede advertir, un mapa de riesgo de propagación epidemiológica, elaborado con técnicas de análisis espacial con información limitada, ayuda a ubicar de manera pronta a los principales 20 municipios por donde es altamente probable que se desencadenarse una epidemia detonada por agentes virales trasmisibles por fómites, superficies contaminadas y de persona a persona. Las limitantes de este modelo práctico pueden balancearse considerando que, a 90 días de la epidemia de COVID-19 en Veracruz, diez de los municipios que en la realidad presentaron escasos casos de contagio caen dentro de los 20 municipios con los más bajos niveles de riesgo de propagación epidemiológica calculada.
De modo que esta técnica para que crezca en precisión requiere de otros insumos censales, tales como: empadronamiento vehicular, censo de mascotas, censo de comercio ambulante, censo de residencia vs lugar de trabajo, entre varios más, todos acoplados a la georreferenciación estadística de INEGI, a las áreas geoestadísticas básicas AGEBs, para que en un futuro los brotes epidémicos no tomen por sorpresa a las autoridades y demás tomadores de decisión en turno, todo ello con la intención de aspirar a reducir el número de contagios pero sobre todo de defunciones.
Referencias
Agostoni, C.
(2017) Red Stamps and the National Committee Against Tuberculosis, Mexico City, 1939-1950. Revista CONAMED, 22(4), 199-201.
(2019) The road from the antituberculosis armory to the Huipulco Tuberculosis Sanatorium in Mexico City, 1920-1940. Historia, Ciencias, Saude-Manguinhos, 26(2), 519-536.
Aguirre, A. & González, E.
(1992) The feasibility of forecasting influenza epidemics in Cuba. Memorias do Instituto Oswaldo Cruz, 87(3), 429-432.
Alexander, R. M.
(2020) The Fever of War: Epidemic Typhus and Public Health in Revolutionary Mexico City, 1915-1917. Hispanic American Historical Review, 100(1), 63-92.
Báez, A.; Pérez, J., & Salazar, M.
(2003) Epidemiology of Tuberculosis in Mexico, 1981-1998 Inconsistencies between reports from the World Health Organization and the Ministry of Health. Salud Pública de Mexico, 45(2), 78-83.
Baine, W.; Farmer III, J.; Gangarosa, E.; Hermann, G.; Thornsberry, C., & Rice, P.
(1977) Typhoid fever in the United States associated with the 1972-1973 epidemic in Mexico. Journal of Infectious Diseases, 135(4), 649-653.
Bletzer, K.
(1998) Culture and Sexual Risk: Anthropological Perspectives on AIDS. Medical Anthropology Quarterly, 12(4), 504-508.
Boender, G.; Hagenaars, T.; Bouma, A.; Nodelijk, G.; Elbers, A.; Jong, M., & Van Boven, M.
(2007) Risk maps for the spread of highly pathogenic avian influenza in poultry. PLoS computational biology, 3(4), 704-712.
Burns, J.; Acuna, R., & Stahle, D.
(2014) Drought and epidemic typhus, central Mexico, 1655-1918. Emerging Infectious Diseases, 20(3), 442.
Bustamante, L.; Bellido, F.; Riojas, H.; Borja, V.; Yannez, L., & Becerra, F.
(1996) Sociodemographic characteristics of people who died from pulmonary tuberculosis in Veracruz, Mexico, 1993. Salud Pública de México, 38(5), 323-331.
Canada, W.
(1901) Mexico, Mortality of the county of Vera Cruz from yellow fever, pernicious fever, remittent fever, and tuberculosis from January 1, 1899, to June 30, 1901. Public Health Reports (1896-1970), 16(36), 2084-2085.
Cano, B.
(2013) La influenza española en México: el caso de los estados fronterizos (1918-1919). En Molina, A.; Márquez, L. & Pardo, C. (Eds.), El miedo a morir. Endemias, epidemias y pandemias en México: análisis de larga duración (275-288), Centro de Investigaciones y Estudios Superiores en Antropología Social, México.
Correa, P.; Calisher, C., & Baer, G.
(1972) Epidemic strain of Venezuelan equine encephalomyelitis virus from a vampire bat captured in Oaxaca, Mexico, 1970. Science, 175(4021), 546-547.
Dodge, M.; Kitchin, R., & Perkins, C.
(2011) The Map Reader: Theories of Mapping Practice and Cartographic Representation, John Wiley & Sons, Nueva York, 504 pp.
Frost, M.; Li, R.; Moolenaar, R., & Xie, R.
(2019) Progress in public health risk communication in China: lessons learned from SARS to H7N9. BMC public health, 19(3), 475.
García, V.; Pérez, J.; Molina, A.
(2003) Desastres agrícolas en México: catálogo histórico, Épocas prehispánica y colonial (958-1822), Centro de Investigaciones y Estudios Superiores en Antropología Social; Fondo de Cultura Económica, México, 506 pp.
Góngora, R.; Castro, C.; Valadez, N.; González, P.; Pavía, N.; Lara, D., & Vivas, M.
(2005) The HIV/AIDS epidemic in Yucatan, Mexico: an investigative based approach (1985-2004). Revista Biomédica, 16(1), 29-45.
González, A.; Gosset, G.; Zárate, M.; Vidales, N.; Vega D., & Arnas, S.
(1976) Estudio de una epidemia de poliomielitis en el estado Sinaloa, México. Revista de Investigación en Salud Publica, 36(1), 37-54.
Hogan, Michael
(2010) Virus. En Cutler J., & Cleveland (Eds.), Encyclopedia of Earth, Environmental Information Coalition, National Council for Science and the Environment, Washington, D.C. Disponible en: https://eol.org/docs/discover/viruses
Instituto Nacional de Estadística y Geografía (INEGI)
(2019) Directorio Estadístico Nacional de Unidades Económicas, Aguascalientes. http://www.beta.inegi.org.mx/app/mapa/denue/.
(2016) Cartografía Geoestadística Urbana y Rural Amanzanada, Junio 2016. Veracruz de Ignacio de la Llave, Aguascalientes, INEGI,
http://internet.contenidos.inegi.org.mx/contenidos/Productos/prod_serv/contenidos/espanol/bvinegi/productos/geografia/CGURA_Junio2016/Veracruz_de_Ignacio_de_la_Llave/702825218973_s.zip
(2010) Censo de Población y Vivienda 2010, tabulados básicos, México: Instituto Nacional de Geografía Estadística e Informática.
https://www.inegi.org.mx/programas/ccpv/2010/
(2000) XII Censo General de Población y Vivienda 2000, tabulados básicos, México: Instituto Nacional de Geografía Estadística e Informática,
https://www.inegi.org.mx/programas/ccpv/2000/
(1990) XI Censo General de Población y Vivienda 1990, tabulados básicos, México: Instituto Nacional de Geografía Estadística e Informática,
https://www.inegi.org.mx/programas/ccpv/1990/ 19 de mayo de 2017.
Lizárraga, M., & Quilici, M.
(2009) Molecular analyses of Vibrio cholerae O1 clinical strains, including new nontoxigenic variants isolated in Mexico during the cholera epidemic years between 1991 and 2000. Journal of Clinical Microbiology, 47(5), 1364-1371.
Loroño, M.; Farfán, J.; Rosado, E.; Kuno, G., & Gubler, D.
(1993) Epidemic dengue 4 in the Yucatan, Mexico, 1984. Revista do instituto de medicina tropical de Sao Paulo, 35(5), 449-455.
Luna, M.; Escarzaga, E.; Zúñiga, V.; Gutiérrez, M., & Ruíz, J.
(1972) Salmonella typhi epidemic (Mexico, 1972), in vitro sensitivity to various antimicrobial agents. La prensa médica mexicana, 37(7), 256-258.
Magis, C., & Loo, E.
(1996) Epidemic of AIDS in Mexico, Global analysis 1981-1996. Gaceta médica de México, 132(5), 545-550.
Miller, J.; Tam, T.; Maloney, S.; Fukuda, K.; Cox, N.; Hockin, J., & Cetron, M.
(2000) Cruise ships: high-risk passengers and the global spread of new influenza viruses. Clinical Infectious Diseases, 31(2), 433-438.
Molina, A.; Márquez, L.; & Pardo, C.
(2013) El miedo a morir, Endemias, epidemias y pandemias en México: análisis de larga duración, Centro de Investigaciones y Estudios Superiores en Antropología Social, Instituto Mora, Benemérita Universidad Autónoma de Puebla, México, 557 pp.
Neves, J.
(1968) Informe sobre el control de la tuberculosis en la frontera México-Estados Unidos 2 sep-31 oct 1968, World Health Organization-Regional Office for the Americas (WHO/AMOR), pp. AMRO-3108.
Orubuloye, I. O.; Caldwell, P., & Caldwell, J. C.
(1993) The role of high-risk occupations in the spread of AIDS: truck drivers and itinerant market women in Nigeria. International Family Planning Perspectives, 19(2), 43-71.
Perdigón, G., & Fernández, S.
(2009) Recent evolution of behavior of the viral hepatitis in Mexico, 1990-2007. Boletín Médico del Hospital Infantil de México, 66(2), 204-207.
Pizarro, E.; Medina, G.; Gosset, G.; González, A., & Pérez, S.
(1977) Epidemiologic surveillance of influenza, Epidemic outbreaks in Mexico, DF, in February 1976. Salud Pública de Mexico, 19(5), 681-684.
Prati, G.; Pietrantoni, L., & Zani, B.
(2011) A social-cognitive model of pandemic influenza H1N1 risk perception and recommended behaviors in Italy. Risk Analysis: An International Journal, 31(4), 645-656.
Quezada, A.
(2012) “Death, Disease and Disregard, A Review of Heather McCrea’s Diseased Relations: Epidemics, Public Health, and State-Building in Yucatán, Mexico, 1847-1924. A Contracorriente, 9(3), 457-463.
Roca, C. & Balanzó, X. D.
(2006) Enfermedades importadas en inmigrantes: mito y realidad. Anales del Sistema Sanitario de Navarra, (29), 139-144, España: Gobierno de Navarra, Departamento de Salud.
Secretaría de Salud
(2017) Boletín Epidemiológico, México: Dirección General de Epidemiología, Recuperado el 11 de noviembre de 2017 de:
https://www.gob.mx/salud/acciones-y-programas/historico-boletin-epidemiologico
Sifuentes, J.
(2006) Tuberculosis in Mexico: a brief report of a population-based study in Orizaba, 1995-2006. 대한결핵및호흡기학회 추계학술발표초록집, (103), 227-228.
Steffen, R.
(2010) Influenza in travelers: epidemiology, risk, prevention, and control issues. Current infectious disease reports, 12(3), 181-185.
Remschmidt, C.; Stöcker, P.; Heiden, M.; Suess, T.; Luchtenberg, M.; Schink, S., & Buchholz, U.
(2013) Preventable and non-preventable risk factors for influenza transmission and hygiene behavior in German influenza households, pandemic season (H1N1) 2009/2010. Influenza And Other Respiratory Viruses, 7(3), 418-425.
Vázquez, S.
(2013) “Análisis de la salud y calidad de vida en adultos mayores en dos zonas climáticas de Veracruz, tesis de maestría, Universidad Veracruzana-Instituto de Salud Pública, Xalapa, 118 pp.
Velázquez, O.; Stetler, H.; Avila, C.; Ornelas, G.; Alvarez, C.; Hadler, S., & Sepúlveda, J.
(1990) Epidemic transmission of enterically transmitted non-A, non-B hepatitis in Mexico, 1986-1987. Jama, 263(24), 3281-3285.
Verduzco, G.
(1980) Tuberculosis mortality in Mexico during the period 1963-74. Salud Pública de México, 22(2), 191-228.
Zárate, M.; González, A.; Gosset, G.; Mireles, M., & Cervantes, L.
(1976) Poliomyelitis in Tabasco State (Mexico), The 1974 epidemic in Chontalpa. Revista de Investigación en Salud Pública, 36(1), 55-70.
ANTROPOLOGÍA AMERICANA, vol. 6, núm. 11 (2021), pp. 85-112 ISSN (impresa): 2521-7607 ISSN (en línea): 2521-7615
Continuación Tabla 7